Jak funguje Hydrotect
Na letošním 6. mezinárodním stavebním veletrhu IBF 2001 v Brně byly ve stánku a.s. RAKO představeny keramické obkladové a dlažební prvky RAKO HYDROTECT s antibakteriálními a samočisticími účinky. Pravděpodobně z časových důvodů nebyl tento výrobek oceněn Zlatou medailí, ačkoli jde svým způsobem o revoluční novinku, která má předpoklady založit novou etapu ve zlepšování užitných vlastností stavební keramiky. V tomto příspěvku pojednáme o mechanismech fungování povrchové vrstvy HYDROTECT.
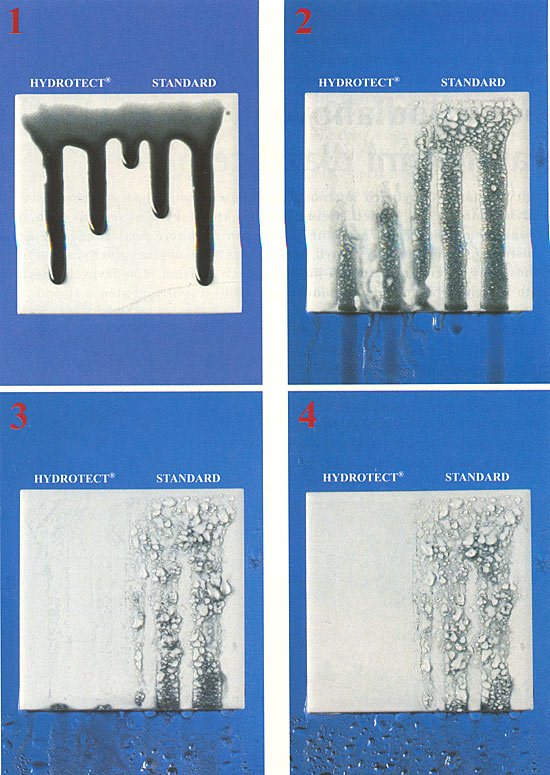
Hydrotect je speciální neviditelná povrchová úprava keramických obkladových prvků, jejímž základem je několik mikronů silná vrstva oxidu titaničitého s převažujícím podílem krystalické formy anatasu nanesená a samostatně vypálená na lícovém povrchu obkladového prvku. Tato vrstva vykazuje pozoruhodné efekty vycházející z fotokatalytických vlastností TiO2. Jsou to především antibakteriální účinky a velmi vysoká smáčivost povrchu vodou a jinými polárními kapalinami. Četnými pokusy bylo také prokázáno, že povrch TiO2 je schopen oxidovat různé chemické sloučeniny včetně organických látek, u nichž oxidace probíhá, až na oxid uhličitý a vodu. Tím dochází k částečnému čištění a likvidaci nepříjemného zápachu. Podobně jsou napadány i živé buňky, takže povrch likviduje mikroorganismy, brání růstu řas, plísní a choroboplodných zárodků.
Co se týče mechanismu fungování povrchové vrstvy HYDROTECT, pak je třeba říct, že dostupné původní informace jsou poněkud kusé. Proto model, který uvádíme, je shrnutím nejdůležitějších poznatků z oblasti chemie a fyziky pevných látek aplikovaných na oxid titaničitý TiO2. Vychází se přitom z práce A. Hellera, A. Fujishimy a K. Hondy, kteří v 70. letech uplynulého století popsali u této látky fotokatalytický jev: Při dopadu ultrafialového světla na povrch krystalu anatasu se uvolňují z jeho povrchu elektrony. Za přítomnosti vody se pak na povrch váží hydroxylové skupiny OH–. Vazba je tak pevná, že se na monomolekulární vrstvě OH– fyzikálně váží další vrstvy vody a ty odpuzují ostatní látky. Uvolněné elektrony mají silnou schopnost vytvářet aktivní kyslík [1].
Co je to anatas?
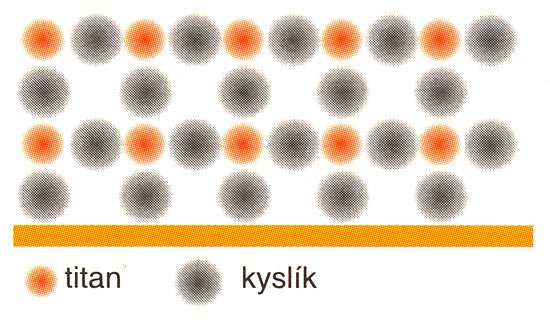
Krystal anatasu si lze představit jako čtverečné rovinné mříže složené z iontů kyslíku O2- vrstvené nad sebou tak, že každý kyslíkový iont vrchní mříže leží právě nad středem elementárního čtverce spodní mříže. Kationty titanu Ti4+ jsou pak umístěny do každé druhé kyslíkové vrstvy ve středech elementárních kyslíkových čtverců, aby byl krystal elektroneutrální (na iont Ti4+ připadají dva ionty O2-). Pokud není iont Ti4+ na povrchu krystalu, je obklopen 6 ionty kyslíku a každý iont O2– je obklopen buď čtyřmi nebo dvěma ionty Ti4+. Tuto skutečnost představuje pohled "z profilu" obr. 1.
Jak vrstva Hydrotect funguje?
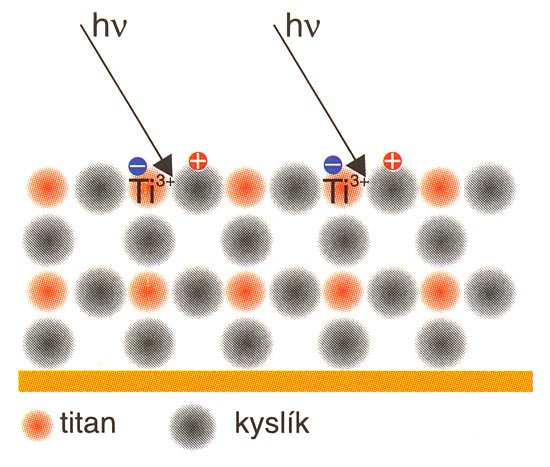
Základem je známý fakt, že kationty titanu za vhodných podmínek relativně snadno mění mocenství Ti4+ ←→ Ti3+, což je obecná vlastnost všech tzv. přechodových prvků. Podle japonských techniků, již asistovali při licenčním prodeji technologie Hydrotect, obsahuje neaktivovaná vrstva Hydrotect pouze čtyřmocný titan Ti4+.
Aktivace
Působením světla obsahujícího ultrafialovou složku s délkou vlny pod 380 nm (odpovídá energii fotonu hν = 3,25 eV) se redukuje kationt Ti4+ na Ti3+ jak ukazuje obr. 2.
V reprezentaci tzv. pásového modelu to znamená, že z obsazeného valenčního pásu přestoupí do vodivostního pásu elektron a po něm ve valenčním pásu zůstane díra. Oba nositelé náboje, elektron a díra, mají velkou pohyblivost a vysoký redukčně oxidační potenciál odpovídající energii pohlceného fotonu.Vzniklá dvojice elektron - díra může zpět rekombinovat za vzniku tepla nebo intereagovat s molekulou vzdušného kyslíku (A) nebo řidčeji přímo s molekulou vody (B):
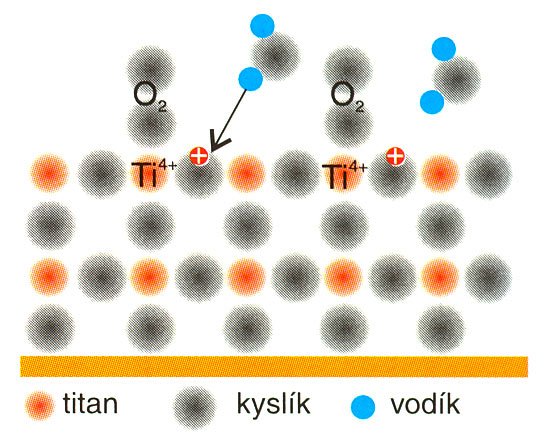
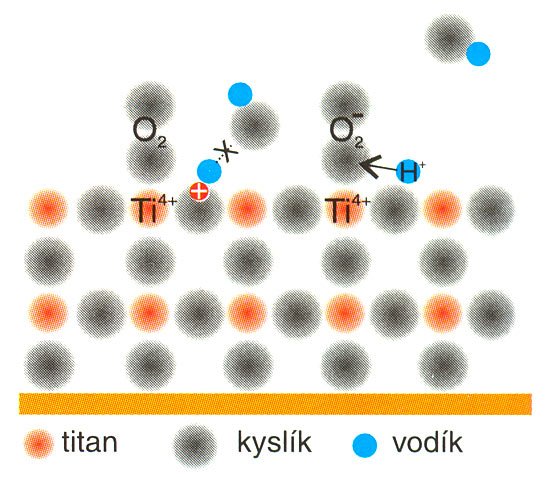
A) Molekula kyslíku s vysokou elektronovou afinitou (kyslík, paramagnetický plyn, má v molekule dva nepárované a tedy silně vazné elektrony) »odchytí« vzbuzený elektron naváže se na iont titanu částečně chemicky, ale zejména elektrostatickou silou, obr. 3. V této se vzbuzený elektron lokalizuje a sníží se tak jeho schopnost rekombinace. Děj je popsán rovnicemi
O2 + e– → O2– nebo
Ti3+ + O2 → Ti4+ + O2-
Tato schopnost kyslíku má, jak ukážeme, zásadní vliv na oxidační a antibakteriální účinky Hydrotectu. Zbylá volná díra (označení h+) na povrchu krystalové mříže pak v přítomnosti vzdušné vlhkosti rozkládá molekulu vody za vzniku atomu vodíku a volné, silně reaktivní hydroxylové skupiny podle rovnice:
H2O + h+ → •OH + H+
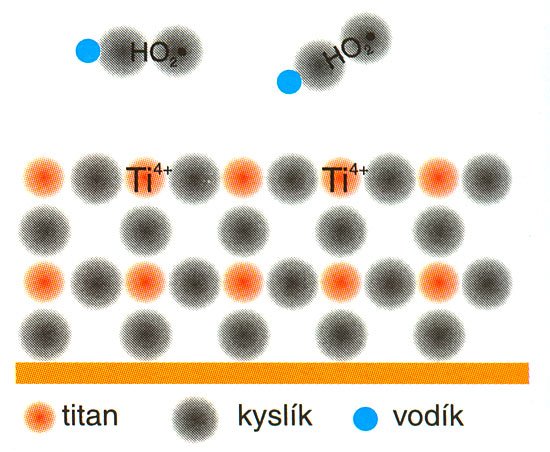
Odtržený vodík předá okamžitě elektron do valenčního pásu a vzniklý vodíkový kationt H+ se elektrostaticky váže na povrchu mříže. Radikál •OH, ač velmi reaktivní, se nemá možnost vázat na krystalovou mříž, proto se od povrchu odpoutá a působí silně oxidačně v přilehlém okolí, obr. 4. Tím, že se do valenčního pásu vrátí elektron, se nasytí vaznost titanu, který pak zcela předá elektron molekule kyslíku. Opačně nabité ionty H+ a O2–, které kromě elektrostatických sil k mříži nic nepoutá, se spojí za vzniku neutrálního peroxidického radikálu HO2•. A protože tento radikál není schopen poskytnout vazebnou elektronovou dvojici, vazba titanového iontu s molekulou kyslíku se po svém katalytickém účinkování rozpadne. Radikál HO2• opustí povrch Hydrotectu a působí podobně jako hydroxylová skupina velmi agresivně, obr. 5.
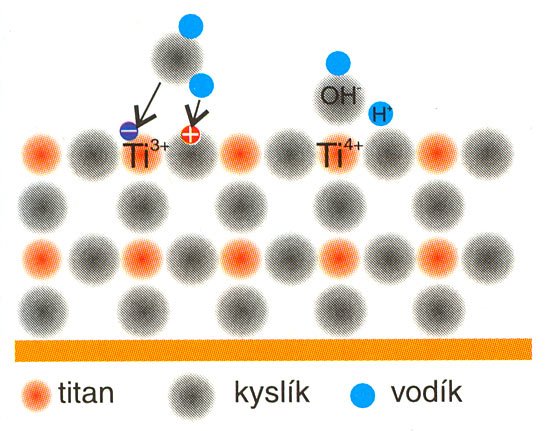
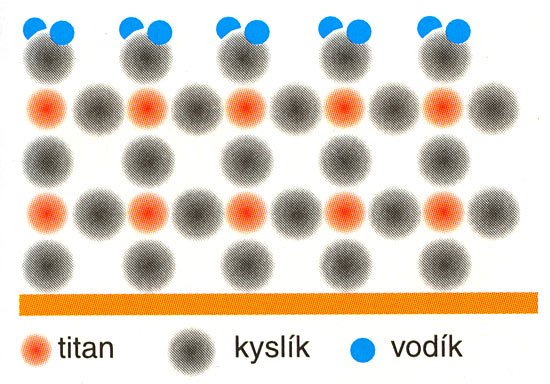
B) Odehraje-li se fotonová excitace na pár elektron - díra , viz obr. 2, v blízkosti molekuly vody, nestačí se na iont Ti3+ vázat kyslík a roli akceptoru elektronu sehraje po rozpadu molekuly vody hydroxylový radikál •OH, který přejde na kationt OH– poutaný elektrostaticky k iontu Ti4+ se slabým kovalentním příspěvkem, obr. 6. Kationt H+ se pak váže na OH– skupinu. Výsledkem je vlastně voda vázaná koordinační vazbou na iont Ti4+, viz obr. 7. Pro tuto vazbu poskytuje vazebný elektronový pár voda, což nešlo v případě radikálu HO2•. Tato vazba se na povrchu za přispění relativně pevných vodíkových můstků stabilizuje a způsobuje mimořádnou smáčivost vrstvy Hydrotect. Chemicky přitom jde vlastně o hydrataci oxidu titaničitého na kyselinu titaničitou:
TiO2 + H2O → H2TiO3
Dynamický děj
Na celý děj je nutno pohlížet dynamicky. Světelnou expozicí povrchu se začnou na povrchu Hydrotect genetovat páry elektron - díra, které zároveň rychle rekombinují, ale při konstantní expozici se jejich koncentrace ustálí na nějaké hodnotě. Vzdušný kyslík váže elektrony a lokalizuje je na iontech titanu, kde jakoby zamrznou a podstatně se sníží jejich schopnost rekombinovat s děrami. Když se pak setká díra s molekulou vody (vzdušná vlhkost), disociuje ji za vzniku volných radikálů •OH, peroxidických radikálů HO2• a na povrchu se váží hydroxylové skupiny, na které se »lepí« vodíkové kationty za vzniku vázané H2, jež představuje jakousi krystalovou vodu. Teplem i působícím zářením se voda uvolňuje a celý děj se opakuje. Jde tedy o jakýsi kontinuální stroj, do kterého se dodává vzdušný kyslík, vlhkost a energie v podobě slunečního záření, a který produkuje silně reaktivní oxidující látky a vytváří na povrchu Hydrotectu vysoce hydrofilní podmínky. Po skončení expozice ustane tvorba reaktivních látek a povrchově vázaná voda se postupně odbourává.
Účinnost i ve tmě
Poznamenejme, že pro prodloužení antibakteriálního a hydrofilního účinku se přidává do vrstvy TiO2 malé množství oxidu stříbrného Ag2O, který po zabudování do krystalové mříže během výpalu účinkuje jako akceptorová chemická dotace. To znamená, že i světlem neaktivovaná vrstva Hydrotectu obsahuje volné díry - akceptory elektronů, čímž zejména procesy vedoucí k hydrofilitě mohou do jisté míry probíhat i ve tmě.